各市,、自治州人民政府,省政府各委、辦,、廳,、局:
《青海省疫苗藥品安全突發(fā)事件應(yīng)急預(yù)案》已經(jīng)省政府同意,,現(xiàn)印發(fā)給你們,,請(qǐng)結(jié)合實(shí)際認(rèn)真組織實(shí)施。
青海省人民政府辦公廳
2022年12月2日
(此件公開發(fā)布)
青海省疫苗藥品安全突發(fā)事件
應(yīng)急預(yù)案
目???錄
1??總則……………………………..........................…..……………(6)
1.1??編制目的………………………..........................……………………(6)
1.2??編制依據(jù)………………………………..........................……………(6)
1.3??適用范圍…………………..........................…………………………(6)
1.4??工作原則………………………..........................……………………(7)
1.5??事件分級(jí)…………………………..........................…………………(7)
2??組織機(jī)構(gòu)及職責(zé)………………………...................……………(14)
2.1??省疫苗藥品安全突發(fā)事件應(yīng)急指揮部……................………(14)
2.2??應(yīng)急處置工作組……………………………….......................……(15)
2.3??省以下疫苗藥品安全突發(fā)事件應(yīng)急機(jī)構(gòu)…................………(18)
3??監(jiān)測(cè)與預(yù)警………………...………….........................…………(18)
3.1??監(jiān)測(cè)…………………………………..................................….....……(18)
3.2??預(yù)警……………………………………….............................…………(19)
4??信息報(bào)告………………………............……………………………(21)
4.1??報(bào)告責(zé)任單位和報(bào)告人………….....................…………………(21)
4.2??報(bào)告程序和時(shí)限…………………………….......................………(22)
4.3??報(bào)告內(nèi)容………………………………….........................…………(22)
4.4??報(bào)告方式………………………………….........................…………(23)
5??應(yīng)急響應(yīng)……………………………………....................………(23)
5.1??事件評(píng)估……………………........................………………………(23)
5.2??先期處置………………………………………........................……(24)
5.3??分級(jí)響應(yīng)……………………………………........................………(24)
5.4??信息發(fā)布……………………………………........................………(29)
5.5??響應(yīng)調(diào)整……………………………………........................………(29)
5.6??響應(yīng)終止………………………........................……………………(30)
6??后期處置……………………………………….........……………(30)
6.1??善后處置……………………........................………………………(30)
6.2??事件調(diào)查…………………………........................…………………(31)
6.3??總結(jié)評(píng)估……………………………........................………………(31)
6.4??責(zé)任與獎(jiǎng)懲…………………………….......................……………(31)
7??應(yīng)急保障…………………………..........……………………..…(32)
7.1??隊(duì)伍保障……………….......................……………………………(32)
7.2??信息保障……………………………….......................……………(32)
7.3??醫(yī)療保障……………………………………….......................……(32)
7.4??技術(shù)保障……………………………………….......................……(32)
7.5??后勤保障………………………….......................…………………(33)
7.6??社會(huì)動(dòng)員保障…………………………….....................…………(33)
8??預(yù)案管理…………………………........…………………………(33)
8.1??預(yù)案編制與備案………………....................……………………(33)
8.2??預(yù)案演練………………………......................……………………(34)
8.3??預(yù)案評(píng)估與修訂…………………………....................…………(34)
8.4??宣傳與培訓(xùn)………………………………….....................………(34)
9??附則…………………………………………….......……………(35)
9.1??預(yù)案解釋………………………………….....................…………(35)
9.2??預(yù)案實(shí)施…………………………………….....................………(35)
附件?……………………………………….......……………………(36)
1??總則
1.1??編制目的,。
深入貫徹習(xí)近平總書記關(guān)于藥品(含醫(yī)療器械,、化妝品,下同)安全工作的重要指示批示精神,,建立健全疫苗藥品安全突發(fā)事件應(yīng)對(duì)工作機(jī)制,,科學(xué)、高效,、快速,、有序做好應(yīng)急處置工作,最大限度地減少危害,,保障公眾健康和生命安全,,維護(hù)正常社會(huì)經(jīng)濟(jì)秩序,。
1.2??編制依據(jù),。
依據(jù)《中華人民共和國(guó)突發(fā)事件應(yīng)對(duì)法》《中華人民共和國(guó)藥品管理法》《中華人民共和國(guó)疫苗管理法》《突發(fā)公共衛(wèi)生事件應(yīng)急條例》《中華人民共和國(guó)藥品管理法實(shí)施條例》《麻醉藥品和精神藥品管理?xiàng)l例》《醫(yī)療器械監(jiān)督管理?xiàng)l例》《化妝品監(jiān)督管理?xiàng)l例》《突發(fā)事件應(yīng)急預(yù)案管理辦法》《市場(chǎng)監(jiān)管突發(fā)事件應(yīng)急管理辦法》《藥品生產(chǎn)監(jiān)督管理辦法》《藥品不良反應(yīng)報(bào)告和監(jiān)測(cè)管理辦法》《藥品召回管理辦法》《疫苗生產(chǎn)流通管理規(guī)定》《青海省突發(fā)事件總體應(yīng)急預(yù)案》等法律、行政法規(guī),、規(guī)章及相關(guān)規(guī)范性文件,,制定本預(yù)案。
1.3??適用范圍,。
本預(yù)案適用于青海省行政區(qū)域內(nèi)突然發(fā)生,,造成或可能造成人體健康損害的疫苗藥品安全突發(fā)事件的應(yīng)急處置,包括疫苗安全突發(fā)事件,、藥品安全突發(fā)事件,、醫(yī)療器械安全突發(fā)事件和化妝品安全突發(fā)事件。發(fā)生在其他省區(qū)需本省做出應(yīng)急反應(yīng)的事件,,參照本預(yù)案執(zhí)行,。
1.4??工作原則。
(1)人民至上,、生命至上,。牢固樹立以人民為中心的發(fā)展思想,把保障人民群眾生命財(cái)產(chǎn)安全作為首要任務(wù),最大限度防范安全風(fēng)險(xiǎn),、減少人員傷亡,、降低經(jīng)濟(jì)損失、控制社會(huì)影響,。
(2)統(tǒng)一領(lǐng)導(dǎo),、分級(jí)負(fù)責(zé)。在省委,、省政府統(tǒng)一領(lǐng)導(dǎo)下,,各級(jí)人民政府履行主體責(zé)任,統(tǒng)籌應(yīng)急資源,,協(xié)調(diào)應(yīng)急力量,,動(dòng)員社會(huì)參與,積極做好應(yīng)急處置工作,。
(3)反應(yīng)及時(shí),、措施果斷。完善應(yīng)急聯(lián)動(dòng)機(jī)制,,加強(qiáng)力量建設(shè),,快速響應(yīng),果斷處置,,全力控制事件影響,。
(4)依靠科學(xué)、加強(qiáng)合作,。遵照國(guó)家法律法規(guī)和相關(guān)政策規(guī)定,,利用科學(xué)手段和技術(shù)裝備,充分發(fā)揮專業(yè)隊(duì)伍作用,,加強(qiáng)相關(guān)部門間配合,,采取聯(lián)合檢查、聯(lián)合執(zhí)法的形式,,確保風(fēng)險(xiǎn)管控到位,、應(yīng)急投入到位、應(yīng)急處置到位,。
1.5??事件分級(jí),。
1.5.1??疫苗安全突發(fā)事件分級(jí)標(biāo)準(zhǔn)。
(1)符合下列情形之一的,,為特別重大疫苗安全突發(fā)事件:
①同一批號(hào)疫苗短期內(nèi)引起5例(含)以上受種者死亡,,疑似與質(zhì)量相關(guān)的事件;
②在相對(duì)集中的時(shí)間和區(qū)域內(nèi),批號(hào)相對(duì)集中的同一疫苗引起臨床表現(xiàn)相似的,,且罕見或非預(yù)期的不良事件的人數(shù)超過20人;或者引起特別嚴(yán)重不良事件(可能對(duì)人體造成永久性傷殘,、對(duì)器官功能造成永久性損傷或危及生命)超過5人,,疑似與質(zhì)量相關(guān)的事件;
③確認(rèn)出現(xiàn)質(zhì)量問題,涉及2個(gè)以上省(自治區(qū),、直轄市)的;
④其他危害特別嚴(yán)重且引發(fā)社會(huì)影響的疫苗安全突發(fā)事件,。
(2)符合下列情形之一的,為重大疫苗安全突發(fā)事件:
①同一批號(hào)疫苗短期內(nèi)引起2例以上,、5例以下受種者死亡,,疑似與質(zhì)量相關(guān)的事件;
②在相對(duì)集中的時(shí)間和區(qū)域內(nèi),批號(hào)相對(duì)集中的同一疫苗引起臨床表現(xiàn)相似的,,且罕見或非預(yù)期的不良事件的人數(shù)超過10人,、不多于20人;或者引起特別嚴(yán)重不良事件(可能對(duì)人體造成永久性傷殘、對(duì)器官功能造成永久性損傷或危及生命)超過3人,、不多于5人,,疑似與質(zhì)量相關(guān)的事件;
③確認(rèn)出現(xiàn)質(zhì)量問題,涉及我省2個(gè)市(州)的;
④其他危害嚴(yán)重且引發(fā)社會(huì)影響的疫苗安全突發(fā)事件,。
(3)符合下列情形之一的,,為較大疫苗安全突發(fā)事件:
①同一批號(hào)疫苗引起1例以上受種者死亡,疑似與質(zhì)量相關(guān)的事件;
②在相對(duì)集中的時(shí)間和區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一疫苗引起臨床表現(xiàn)相似的,,且罕見或非預(yù)期的不良事件的人數(shù)超過5人、不多于10人;或者引起特別嚴(yán)重不良事件(可能對(duì)人體造成永久性傷殘,、對(duì)器官功能造成永久性損傷或危及生命)超過2人,,疑似與質(zhì)量相關(guān)的事件;
③確認(rèn)出現(xiàn)質(zhì)量問題,涉及1個(gè)市(州)的;
④其他危害較大且引發(fā)社會(huì)影響局限于某一省份的疫苗安全突發(fā)事件,。
(4)符合下列情形之一的,,為一般疫苗安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和區(qū)域內(nèi),批號(hào)相對(duì)集中的同一疫苗引起臨床表現(xiàn)相似的,,且罕見或非預(yù)期的不良事件的人數(shù)超過3人,、不多于5人;或者引起特別嚴(yán)重不良事件(可能對(duì)人體造成永久性傷殘,、對(duì)器官功能造成永久性損傷或危及生命)超過1人,,疑似與質(zhì)量相關(guān)的事件;
②其他一般疫苗安全突發(fā)事件。
1.5.2??藥品安全突發(fā)事件分級(jí)標(biāo)準(zhǔn),。
(1)符合下列情形之一的,,為特別重大藥品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),批號(hào)相對(duì)集中的同一藥品(指同一生產(chǎn)企業(yè)生產(chǎn)的同一名稱,、同一劑型的藥品,,下同)引起臨床表現(xiàn)相似的,且罕見的或非預(yù)期的不良事件的人數(shù)超過50人(含);或者引起特別嚴(yán)重不良事件(可能對(duì)人體造成永久性傷殘,、對(duì)器官功能造成永久性損傷或危及生命,,下同)的人數(shù)超過10人(含),,疑似與質(zhì)量相關(guān)的事件;
②使用同一批號(hào)藥品短期內(nèi)引起5人以上患者死亡;
③短期內(nèi)2個(gè)以上省(自治區(qū)、直轄市,,其中包括本省)因同一藥品發(fā)生重大藥品安全突發(fā)事件;
④其他危害特別嚴(yán)重的藥品安全突發(fā)事件,。
(2)符合下列情形之一的,為重大藥品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一藥品引起臨床表現(xiàn)相似的,,且罕見的或非預(yù)期的不良事件的人數(shù)超過30人(含),少于50人;或者引起特別嚴(yán)重不良事件,,涉及人數(shù)超過5人(含),,疑似與質(zhì)量相關(guān)的事件;
②使用同一批號(hào)藥品短期內(nèi)引起2人以上、5人以下患者死亡,,且在同一區(qū)域內(nèi)同時(shí)出現(xiàn)其他類似病例;
③短期內(nèi)本省2個(gè)以上市(州)因同一藥品引發(fā)較大藥品安全突發(fā)事件;
④其他危害嚴(yán)重的藥品安全突發(fā)事件,。
(3)符合下列情形之一的,為較大藥品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一藥品引起臨床表現(xiàn)相似的,,且罕見的或非預(yù)期的不良事件的人數(shù)超過20人(含),少于30人;或者引起特別嚴(yán)重不良事件,,涉及人數(shù)超過3人(含),,疑似與質(zhì)量相關(guān)的事件;
②使用同一批號(hào)藥品短期內(nèi)引起2人(含)以下患者死亡,且在同一區(qū)域內(nèi)同時(shí)出現(xiàn)其他類似病例;
③短期內(nèi)本省1個(gè)市(州)內(nèi)2個(gè)以上縣(市,、區(qū),、行委)因同一藥品引發(fā)一般藥品安全突發(fā)事件;
④其他危害較大的藥品安全突發(fā)事件。
(4)符合下列情形之一的,,為一般藥品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一藥品引起臨床表現(xiàn)相似的,且罕見的或非預(yù)期的不良事件的人數(shù)超過10人(含),,少于20人;或者引起特別嚴(yán)重不良事件,,涉及人數(shù)超過2人(含),疑似與質(zhì)量相關(guān)的事件;
②其他一般藥品安全突發(fā)事件,。
1.5.3??醫(yī)療器械安全突發(fā)事件分級(jí)標(biāo)準(zhǔn),。
(1)符合下列情形之一的,為特別重大醫(yī)療器械安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一醫(yī)療器械(指同一生產(chǎn)企業(yè)生產(chǎn)的同一名稱,、同一規(guī)格的醫(yī)療器械,下同)引起臨床表現(xiàn)相似的,,且罕見的或非預(yù)期的不良事件的人數(shù)超過50人(含);或者引起特別嚴(yán)重不良事件(可能對(duì)人體造成永久性傷殘,、對(duì)器官功能造成永久性損傷或危及生命,下同)的人數(shù)超過10人(含),,疑似與質(zhì)量相關(guān)的事件;
②同一批號(hào)醫(yī)療器械短期內(nèi)引起5人以上患者死亡;
③短期內(nèi)2個(gè)以上省(自治區(qū),、直轄市,,其中包括本省)因同一醫(yī)療器械發(fā)生重大醫(yī)療器械安全突發(fā)事件;
④其他危害特別嚴(yán)重的醫(yī)療器械安全突發(fā)事件。
(2)符合下列情形之一的,,為重大醫(yī)療器械安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一醫(yī)療器械引起臨床表現(xiàn)相似的,且罕見的或非預(yù)期的不良事件的人數(shù)超過30人(含),,少于50人;或者引起特別嚴(yán)重不良事件,,涉及人數(shù)超過5人(含),疑似與質(zhì)量相關(guān)的事件;
②同一批號(hào)醫(yī)療器械短期內(nèi)引起2人以上,、5人以下患者死亡,,且在同一區(qū)域內(nèi)同時(shí)出現(xiàn)其他類似病例;
③短期內(nèi)本省2個(gè)以上市(州)因同一醫(yī)療器械發(fā)生較大醫(yī)療器械安全突發(fā)事件;
④其他危害嚴(yán)重的醫(yī)療器械安全突發(fā)事件。
(3)符合下列情形之一的,,為較大醫(yī)療器械安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),,批號(hào)相對(duì)集中的同一醫(yī)療器械引起臨床表現(xiàn)相似的,且罕見的或非預(yù)期的不良事件的人數(shù)超過20人(含),,少于30人;或者引起特別嚴(yán)重不良事件,,涉及人數(shù)超過3人(含),疑似與質(zhì)量相關(guān)的事件;
②同一批號(hào)醫(yī)療器械短期內(nèi)引起2人(含)以下患者死亡,,且在同一區(qū)域內(nèi)同時(shí)出現(xiàn)其他類似病例;
③短期內(nèi)1個(gè)市(州)內(nèi)2個(gè)以上縣(市,、區(qū)、行委)因同一醫(yī)療器械發(fā)生一般醫(yī)療器械安全突發(fā)事件;
④其他危害較大的醫(yī)療器械安全突發(fā)事件,。
(4)符合下列情形之一的,,為一般醫(yī)療器械安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和(或)區(qū)域內(nèi),批號(hào)相對(duì)集中的同一醫(yī)療器械引起臨床表現(xiàn)相似的,,且罕見的或非預(yù)期的不良事件的人數(shù)超過10人(含),,少于20人;或者引起特別嚴(yán)重不良事件,涉及人數(shù)超過2人(含),,疑似與質(zhì)量相關(guān)的事件;
②其他一般醫(yī)療器械安全突發(fā)事件,。
1.5.4??化妝品安全突發(fā)事件分級(jí)標(biāo)準(zhǔn)。
(1)符合下列情形之一的,,為特別重大化妝品安全突發(fā)事件:
①有證據(jù)表明因使用化妝品而導(dǎo)致1人以上死亡的;
②在相對(duì)集中的時(shí)間,,經(jīng)醫(yī)療機(jī)構(gòu)確認(rèn),因使用同一品牌化妝品而導(dǎo)致30例以上消費(fèi)者產(chǎn)生嚴(yán)重不良反應(yīng),、未出現(xiàn)死亡的;
③在相對(duì)集中的時(shí)間,,因使用同一注冊(cè)人、備案人的化妝品在2個(gè)以上省份引發(fā)重大化妝品安全突發(fā)事件的;
④同一注冊(cè)人,、備案人的化妝品因質(zhì)量安全引發(fā)輿情事件、國(guó)務(wù)院領(lǐng)導(dǎo)批示的化妝品安全突發(fā)事件,。
(2)符合下列情形之一的,,為重大化妝品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間,,經(jīng)醫(yī)療機(jī)構(gòu)確認(rèn),因使用同一品牌化妝品而導(dǎo)致20例以上30例以下消費(fèi)者產(chǎn)生嚴(yán)重不良反應(yīng),、未出現(xiàn)死亡的;
②在相對(duì)集中的時(shí)間和區(qū)域,,因使用同一注冊(cè)人、備案人的化妝品在1個(gè)省(自治區(qū),、直轄市)內(nèi)2個(gè)以上市(州)引發(fā)較大化妝品安全突發(fā)事件的;
③同一注冊(cè)人,、備案人的化妝品因質(zhì)量安全引發(fā)國(guó)家級(jí)媒體關(guān)注報(bào)道且引發(fā)社會(huì)廣泛關(guān)注的輿情事件;
④省級(jí)藥品監(jiān)管部門認(rèn)為應(yīng)采取Ⅱ級(jí)應(yīng)急響應(yīng)措施的化妝品安全突發(fā)事件,。
(3)符合下列情形之一的,,為較大化妝品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間和區(qū)域,經(jīng)醫(yī)療機(jī)構(gòu)確認(rèn),,因使用同一品牌化妝品而導(dǎo)致10例以上20例以下消費(fèi)者產(chǎn)生嚴(yán)重不良反應(yīng),、未出現(xiàn)死亡的;
②在相對(duì)集中時(shí)間,因使用同一注冊(cè)人,、備案人的化妝品在1個(gè)市(州)內(nèi)2個(gè)以上縣(市,、區(qū)、行委)引發(fā)一般化妝品安全突發(fā)事件的;
③屬地監(jiān)管部門認(rèn)為應(yīng)采?、蠹?jí)應(yīng)急響應(yīng)措施的化妝品安全突發(fā)事件,。
(4)符合下列情形之一的,為一般化妝品安全突發(fā)事件:
①在相對(duì)集中的時(shí)間,,經(jīng)醫(yī)療機(jī)構(gòu)確認(rèn),,因使用同一品牌的化妝品在本轄區(qū)內(nèi)導(dǎo)致10例以下消費(fèi)者產(chǎn)生嚴(yán)重不良反應(yīng)、未出現(xiàn)死亡的;
②屬地監(jiān)管部門認(rèn)為應(yīng)采?、艏?jí)應(yīng)急響應(yīng)措施的化妝品安全突發(fā)事件,。
2??組織機(jī)構(gòu)及職責(zé)
2.1??省疫苗藥品安全突發(fā)事件應(yīng)急指揮部。
在省委,、省政府的領(lǐng)導(dǎo)下,,設(shè)立省疫苗藥品安全突發(fā)事件應(yīng)急指揮部,負(fù)責(zé)統(tǒng)一指揮協(xié)調(diào)全省疫苗藥品安全突發(fā)事件的應(yīng)急處置工作,。省政府分管副省長(zhǎng)任總指揮,,省政府相關(guān)副秘書長(zhǎng)和省市場(chǎng)監(jiān)管局、省衛(wèi)生健康委,、省藥品監(jiān)管局主要負(fù)責(zé)同志任副總指揮,。成員由省委宣傳部、省委網(wǎng)信辦,、省教育廳,、省工業(yè)和信息化廳、省公安廳,、省民政廳,、省司法廳,、省財(cái)政廳、省交通運(yùn)輸廳,、省衛(wèi)生健康委,、省應(yīng)急廳、省市場(chǎng)監(jiān)管局,、省通信管理局,、省廣電局、省藥品監(jiān)管局等部門(單位)組成,。
省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室設(shè)在省藥品監(jiān)管局,,承擔(dān)省疫苗藥品安全突發(fā)事件應(yīng)急指揮部日常工作,省藥品監(jiān)管局主要負(fù)責(zé)同志兼任辦公室主任,。
2.2??應(yīng)急處置工作組,。
疫苗藥品安全突發(fā)事件發(fā)生后,根據(jù)工作需要,,省疫苗藥品安全突發(fā)事件應(yīng)急指揮部視情設(shè)立以下工作組,。
(1)綜合協(xié)調(diào)組。
牽頭單位:省藥品監(jiān)管局
參與單位:省衛(wèi)生健康委,、省市場(chǎng)監(jiān)管局,、省應(yīng)急廳、省民政廳,、事發(fā)地人民政府等
主要職責(zé):做好疫苗藥品安全突發(fā)事件應(yīng)急處置綜合協(xié)調(diào)工作;收集,、匯總應(yīng)急處置信息,組織省疫苗藥品安全突發(fā)事件應(yīng)急指揮部會(huì)議;承擔(dān)省疫苗藥品安全突發(fā)事件應(yīng)急指揮部交辦的其他工作,。
(2)事件調(diào)查組,。
牽頭單位:省藥品監(jiān)管局
參與單位:省衛(wèi)生健康委、省公安廳,、事發(fā)地人民政府等
主要職責(zé):負(fù)責(zé)對(duì)引發(fā)疫苗藥品安全突發(fā)事件的醫(yī)療行為,、事件發(fā)生的原因和疫苗藥品質(zhì)量進(jìn)行全面調(diào)查,提出調(diào)查結(jié)論和處理意見;組織對(duì)相關(guān)疫苗藥品進(jìn)行應(yīng)急檢驗(yàn),。
(3)危害控制組,。
牽頭單位:省藥品監(jiān)管局
參與單位:省衛(wèi)生健康委、省市場(chǎng)監(jiān)管局,、省公安廳,、事發(fā)地人民政府等
主要職責(zé):負(fù)責(zé)組織對(duì)引發(fā)安全突發(fā)事件的疫苗藥品采取停止生產(chǎn)、經(jīng)營(yíng),、運(yùn)輸(冷鏈運(yùn)輸),、使用和召回等緊急控制措施;查處事件所涉疫苗藥品違法違規(guī)行為的案件。
(4)醫(yī)療救治組。
牽頭單位:省衛(wèi)生健康委
參與單位:事發(fā)地人民政府
主要職責(zé):負(fù)責(zé)指導(dǎo)協(xié)調(diào)醫(yī)療機(jī)構(gòu),,調(diào)配醫(yī)療專家,,組織開展應(yīng)急救治等工作,。
(5)社會(huì)穩(wěn)定組,。
牽頭單位:省公安廳
參與單位:省委網(wǎng)信辦、事發(fā)地人民政府等
主要職責(zé):負(fù)責(zé)維護(hù)治安秩序,,預(yù)防和處置群體事件,,做好矛盾糾紛化解,維護(hù)社會(huì)穩(wěn)定,。
(6)檢測(cè)評(píng)估組,。
牽頭單位:省藥品監(jiān)管局
參與單位:省衛(wèi)生健康委、技術(shù)支撐機(jī)構(gòu)等
主要職責(zé):負(fù)責(zé)提出檢測(cè)方案和要求,,組織實(shí)施相關(guān)檢測(cè),,必要時(shí)指定相關(guān)機(jī)構(gòu)進(jìn)行檢驗(yàn)檢測(cè);查找事件原因,分析事件發(fā)展趨勢(shì),,預(yù)判事件影響,,為事件調(diào)查和應(yīng)急處置等提供技術(shù)支持。
(7)新聞宣傳組,。
牽頭單位:省委宣傳部
參與單位:省委網(wǎng)信辦,、省藥品監(jiān)管局、省廣電局,、事發(fā)地人民政府等
主要職責(zé):負(fù)責(zé)做好信息發(fā)布,、宣傳報(bào)道和輿論引導(dǎo)等工作。
(8)后勤保障組,。
牽頭單位:事發(fā)地人民政府
參與單位:省工業(yè)和信息化廳,、省民政廳、省司法廳,、省財(cái)政廳,、省交通運(yùn)輸廳、省應(yīng)急廳,、省市場(chǎng)監(jiān)管局,、省藥品監(jiān)管局、省通信管理局等
主要職責(zé):負(fù)責(zé)應(yīng)急處置工作所需經(jīng)費(fèi),、物資,、交通運(yùn)輸和通信等保障工作。
(9)專家組,。
根據(jù)應(yīng)急處置工作需要,,省藥品監(jiān)管局會(huì)同省衛(wèi)生健康委成立省疫苗藥品安全突發(fā)事件應(yīng)急指揮部專家組,聘請(qǐng)藥學(xué)、醫(yī)學(xué),、公共衛(wèi)生,、法學(xué)、社會(huì)學(xué),、心理學(xué)等方面的專家組成,,負(fù)責(zé)對(duì)事件進(jìn)行分析評(píng)估和研判,參與制定應(yīng)急處置技術(shù)方案,,形成科學(xué)有效的決策方案,,必要時(shí)直接參與現(xiàn)場(chǎng)處置工作。
2.3??省以下疫苗藥品安全突發(fā)事件應(yīng)急機(jī)構(gòu),。
各市(州),、縣(市、區(qū),、行委)結(jié)合自身實(shí)際,,參照本預(yù)案制定本級(jí)疫苗藥品安全突發(fā)事件應(yīng)急預(yù)案,建立健全疫苗藥品安全突發(fā)事件應(yīng)急組織體系及應(yīng)急管理工作機(jī)制,,明確責(zé)任主體,。發(fā)生疫苗藥品安全突發(fā)事件后,事發(fā)地和可能波及的地方人民政府要立即成立應(yīng)急指揮部,,迅速,、有序開展疫苗藥品安全突發(fā)事件防范和處置工作。
疫苗藥品上市許可持有人,、生產(chǎn)企業(yè),、經(jīng)營(yíng)企業(yè)和使用單位等疫苗藥品相關(guān)企業(yè)應(yīng)當(dāng)落實(shí)疫苗藥品安全主體責(zé)任,建立和完善內(nèi)部監(jiān)測(cè)預(yù)警,、態(tài)勢(shì)研判,、信息通報(bào)、應(yīng)急資源保障等機(jī)制;制定本單位疫苗藥品安全突發(fā)事件應(yīng)急處置方案,,并組織開展培訓(xùn)和應(yīng)急演練;當(dāng)出現(xiàn)可能導(dǎo)致疫苗藥品安全突發(fā)事件的情況時(shí),,要按照有關(guān)程序和要求及時(shí)上報(bào)。
3??監(jiān)測(cè)與預(yù)警
3.1??監(jiān)測(cè),。
各市(州),、縣(市、區(qū),、行委)人民政府和省級(jí)有關(guān)部門依托本級(jí)醫(yī)療機(jī)構(gòu),、疾病預(yù)防控制機(jī)構(gòu)、預(yù)防接種機(jī)構(gòu),、藥品不良反應(yīng)監(jiān)測(cè)機(jī)構(gòu)等建立本級(jí)疫苗藥品安全突發(fā)事件監(jiān)測(cè)體系,,充分發(fā)揮本級(jí)監(jiān)測(cè)機(jī)構(gòu)作用,,及時(shí)掌握疫苗藥品安全突發(fā)事件風(fēng)險(xiǎn)隱患信息。
各市(州),、縣(市,、區(qū)、行委)藥品監(jiān)督管理部門,、衛(wèi)生健康部門對(duì)監(jiān)督抽驗(yàn),、執(zhí)法檢查、醫(yī)療行為中發(fā)現(xiàn)的疫苗藥品安全風(fēng)險(xiǎn)隱患,,以及廣播,、電視,、報(bào)刊,、微信、微博,、論壇等媒體上的疫苗藥品安全熱點(diǎn)敏感信息進(jìn)行跟蹤,、收集、分析和研判,。
3.2??預(yù)警,。
3.2.1??預(yù)警分級(jí)。
疫苗藥品安全突發(fā)事件預(yù)警按照緊急程度,、發(fā)展態(tài)勢(shì)和可能造成的危害程度分為一級(jí),、二級(jí)、三級(jí),、四級(jí),,依次用紅色、橙色,、黃色和藍(lán)色標(biāo)識(shí),,紅色為最高級(jí)別。根據(jù)事件的后續(xù)發(fā)展和采取措施的效果,,預(yù)警可以升級(jí),、降級(jí)或解除。
紅色:已發(fā)生重大疫苗藥品安全突發(fā)事件,,并有可能發(fā)生特別重大疫苗藥品安全突發(fā)事件,。
橙色:已發(fā)生較大疫苗藥品安全突發(fā)事件,并有可能發(fā)生重大疫苗藥品安全突發(fā)事件,。
黃色:已發(fā)生一般疫苗藥品安全突發(fā)事件,,并有可能發(fā)生較大疫苗藥品安全突發(fā)事件。
藍(lán)色:有可能發(fā)生一般疫苗藥品安全突發(fā)事件,。
3.2.2??預(yù)警信息報(bào)送,。
省藥品監(jiān)管局、省衛(wèi)生健康委等有關(guān)部門針對(duì)發(fā)現(xiàn)的苗頭性、傾向性疫苗藥品安全風(fēng)險(xiǎn),,應(yīng)當(dāng)及時(shí)進(jìn)行通報(bào),,實(shí)現(xiàn)信息共享。根據(jù)各自職責(zé)發(fā)布風(fēng)險(xiǎn)預(yù)警信息,,并通報(bào)相關(guān)部門,、事發(fā)地市(州)、縣(市,、區(qū),、行委)人民政府以及可能涉及地區(qū)人民政府做好防范應(yīng)對(duì)工作。
3.2.3??預(yù)警信息發(fā)布,。
縣級(jí)以上人民政府或其授權(quán)的有關(guān)部門根據(jù)有關(guān)法律,、行政法規(guī)和國(guó)務(wù)院規(guī)定權(quán)限和程序,發(fā)布相應(yīng)級(jí)別的疫苗藥品安全突發(fā)事件預(yù)警信息,,決定并宣布有關(guān)地區(qū)進(jìn)入預(yù)警期,,同時(shí)向上一級(jí)人民政府報(bào)告,必要時(shí)可以越級(jí)上報(bào),,并向可能波及地區(qū)人民政府通報(bào),。疫苗藥品安全突發(fā)事件在兩個(gè)以上行政區(qū)域即將發(fā)生、發(fā)生可能性增大或已經(jīng)發(fā)生時(shí),,事發(fā)行政區(qū)域上一級(jí)人民政府同時(shí)發(fā)布預(yù)警信息,。特殊情況,可視情提升發(fā)布層級(jí),。疫苗藥品安全突發(fā)事件預(yù)警信息內(nèi)容主要包括事件類別,、預(yù)警級(jí)別、起始時(shí)間,、可能影響范圍,、警示事項(xiàng)、應(yīng)采取的措施和發(fā)布機(jī)關(guān)等,。
3.2.4??預(yù)警響應(yīng)措施,。
疫苗藥品安全突發(fā)事件預(yù)警信息發(fā)布后,有關(guān)部門,、單位應(yīng)迅速進(jìn)入應(yīng)急狀態(tài),,密切關(guān)注事態(tài)發(fā)展,加強(qiáng)預(yù)警信息互通,,做好應(yīng)急響應(yīng)準(zhǔn)備,,并及時(shí)采取以下措施。
(1)分析研判,。省藥品監(jiān)管局組織有關(guān)部門和機(jī)構(gòu)對(duì)疫苗藥品安全突發(fā)事件信息和輿情進(jìn)行收集,、核查,、匯總和分析研判;及時(shí)組織開展跟蹤監(jiān)測(cè)工作;研判事件發(fā)展趨勢(shì),經(jīng)分析評(píng)估與調(diào)查核實(shí),,可能發(fā)生疫苗藥品安全突發(fā)事件的,,按本預(yù)案規(guī)定做好啟動(dòng)應(yīng)急響應(yīng)準(zhǔn)備。
(2)防范措施,。迅速采取有效防范措施,,防止事件進(jìn)一步蔓延擴(kuò)大。利用各種渠道增加宣傳頻次,,加強(qiáng)對(duì)相關(guān)疫苗藥品以及可能存在的危害進(jìn)行科普宣教,,告知公眾停止使用涉事疫苗藥品。研判停用和封存疫苗藥品對(duì)疫苗藥品供應(yīng)保障的影響,,制定疫苗藥品儲(chǔ)備,、替代使用等措施,保障應(yīng)急救治和臨床需求,。
(3)應(yīng)急準(zhǔn)備,。省疫苗藥品安全突發(fā)事件應(yīng)急指揮部各有關(guān)成員單位進(jìn)入待命狀態(tài);做好調(diào)集應(yīng)急所需物資、裝備和設(shè)備等應(yīng)急保障準(zhǔn)備工作;加強(qiáng)對(duì)事發(fā)地應(yīng)急處置工作的指導(dǎo),,必要時(shí)派出工作組趕赴現(xiàn)場(chǎng)。
(4)宣傳引導(dǎo),。準(zhǔn)確發(fā)布事態(tài)進(jìn)展情況,,組織專家對(duì)可能產(chǎn)生的危害進(jìn)行分析、說明,,加強(qiáng)跟蹤監(jiān)測(cè),,主動(dòng)回應(yīng)社會(huì)關(guān)切,及時(shí)澄清謠言傳言,。
(5)信息互通,。各成員單位間做好預(yù)警信息互通。
3.2.5??預(yù)警調(diào)整,。
預(yù)警信息發(fā)布單位根據(jù)事件的發(fā)展態(tài)勢(shì),、處置情況和評(píng)估結(jié)果,應(yīng)及時(shí)作出預(yù)警級(jí)別提升,、降低和解除的調(diào)整,。
當(dāng)研判可能引發(fā)事件的因素已經(jīng)消除或得到有效控制,預(yù)警發(fā)布單位應(yīng)及時(shí)解除預(yù)警,,終止有關(guān)措施,。
4??信息報(bào)告
4.1??報(bào)告責(zé)任單位和報(bào)告人。
(1)醫(yī)療機(jī)構(gòu),、接種單位;
(2)疾病預(yù)防控制機(jī)構(gòu);
(3)藥品檢驗(yàn),、監(jiān)測(cè)機(jī)構(gòu);
(4)疫苗藥品,、醫(yī)療器械、化妝品生產(chǎn),、批發(fā)企業(yè);
(5)事發(fā)地人民政府;
(6)各級(jí)藥品監(jiān)督管理部門;
(7)鼓勵(lì)其他單位和個(gè)人向各級(jí)人民政府及藥品監(jiān)督管理,、衛(wèi)生健康等部門報(bào)告疫苗藥品安全突發(fā)事件的相關(guān)情況。
4.2??報(bào)告程序和時(shí)限,。
在接到疫苗藥品安全突發(fā)事件信息后,,各級(jí)人民政府及藥品監(jiān)督管理部門、衛(wèi)生健康部門要按照有關(guān)規(guī)定,,立即如實(shí)向上級(jí)人民政府及上級(jí)主管部門報(bào)告,,30分鐘內(nèi)電話報(bào)告初步情況,1小時(shí)內(nèi)書面報(bào)告情況,,因特殊情況難以在1小時(shí)內(nèi)書面報(bào)告的,,要提前口頭報(bào)告并簡(jiǎn)要說明原因,最遲不得超過1小時(shí),。不得遲報(bào),、謊報(bào)、瞞報(bào)和漏報(bào),,同時(shí)通報(bào)可能受影響的地區(qū),、部門和企業(yè)。
4.3??報(bào)告內(nèi)容,。
按照疫苗藥品安全突發(fā)事件發(fā)生,、發(fā)展、控制過程,,事件信息報(bào)告分為初報(bào),、續(xù)報(bào)和終報(bào)。
(1)初報(bào):事發(fā)地藥品監(jiān)督管理部門在獲知疫苗藥品安全突發(fā)事件發(fā)生后報(bào)告的初始信息,,內(nèi)容包括:事件發(fā)生時(shí)間,、地點(diǎn)、危害范圍和程度(患病人數(shù),、診療人數(shù)和危重人數(shù)),、主要癥狀與體征;涉事產(chǎn)品的生產(chǎn)經(jīng)營(yíng)企業(yè)以及產(chǎn)品名稱(批準(zhǔn)文號(hào)、批號(hào)或生產(chǎn)日期),、先期處置情況,、接報(bào)途徑、發(fā)展趨勢(shì)和潛在危害程度,、下一步工作建議,、需要幫助解決的問題以及聯(lián)絡(luò)員信息等。
(2)續(xù)報(bào):事發(fā)地藥品監(jiān)督管理部門在事件處置過程中的階段性報(bào)告,,主要內(nèi)容包括:事件進(jìn)展,、調(diào)查處置情況,、輿論研判、原因分析,、事件影響評(píng)估,、后續(xù)應(yīng)對(duì)措施等信息,并對(duì)前次報(bào)告的內(nèi)容進(jìn)行補(bǔ)充和修正,。續(xù)報(bào)可根據(jù)事件進(jìn)展多次進(jìn)行,,直至事件調(diào)查處理結(jié)束。特別重大疫苗藥品安全突發(fā)事件應(yīng)每日?qǐng)?bào)告事件進(jìn)展情況,,重要情況須隨時(shí)上報(bào),。
(3)終報(bào):事發(fā)地藥品監(jiān)督管理部門在事件處置結(jié)束后的總結(jié)評(píng)估報(bào)告。主要內(nèi)容包括:基本情況,、事件定性,、應(yīng)對(duì)情況、原因分析,、處罰情況,、責(zé)任追究(認(rèn)定)等內(nèi)容,并附流行病學(xué)調(diào)查報(bào)告;對(duì)事件應(yīng)對(duì)處置過程中的經(jīng)驗(yàn)和存在問題進(jìn)行總結(jié)評(píng)估,,并提出今后防范類似事件發(fā)生的措施和建議,。終報(bào)應(yīng)在事件處置結(jié)束后7個(gè)工作日內(nèi)報(bào)送。
4.4??報(bào)告方式,。
事發(fā)地藥品監(jiān)督管理部門可通過電子信箱或傳真等方式向上一級(jí)藥品監(jiān)督管理部門和本級(jí)人民政府報(bào)送初報(bào)和續(xù)報(bào),,緊急情況下,可先通過電話報(bào)告,,再補(bǔ)報(bào)文字報(bào)告。終報(bào)經(jīng)上報(bào)單位主要負(fù)責(zé)同志簽發(fā)后,,以單位正式文件形式上報(bào),。
5??應(yīng)急響應(yīng)
5.1??事件評(píng)估。
事件評(píng)估由藥品監(jiān)督管理部門會(huì)同衛(wèi)生健康部門及專家組開展,。事件評(píng)估是為核定疫苗藥品安全突發(fā)事件級(jí)別和確定應(yīng)采取的措施而進(jìn)行的評(píng)估,。評(píng)估內(nèi)容包括:
(1)事件涉及的疫苗藥品可能導(dǎo)致的健康損害及所涉及的范圍,是否已造成健康損害后果及嚴(yán)重程度;
(2)事件的影響范圍及嚴(yán)重程度;
(3)事件發(fā)展蔓延趨勢(shì),。
5.2??先期處置,。
發(fā)生疫苗藥品安全突發(fā)事件,事發(fā)地市(州),、縣(市,、區(qū)、行委)人民政府以及藥品監(jiān)督管理部門要迅速調(diào)集力量,,對(duì)相關(guān)疫苗藥品采取緊急處置措施,,盡快對(duì)事件性質(zhì)和程度進(jìn)行預(yù)判,,全力控制事態(tài)發(fā)展,減少人身傷害和社會(huì)影響,,并及時(shí)向上級(jí)人民政府和上級(jí)藥品監(jiān)督管理部門報(bào)告,。事發(fā)地醫(yī)療機(jī)構(gòu)應(yīng)立即停止使用疑似造成事件的疫苗藥品,同時(shí)應(yīng)及時(shí)向同級(jí)衛(wèi)生健康主管部門發(fā)出停止使用該品種,、批次疫苗藥品的通報(bào),。
5.3??分級(jí)響應(yīng)。
根據(jù)疫苗藥品安全突發(fā)事件的分級(jí),,將省級(jí)應(yīng)急響應(yīng)設(shè)定為Ⅰ級(jí),、Ⅱ級(jí)、Ⅲ級(jí)和Ⅳ級(jí)四個(gè)等級(jí),。
5.3.1??省級(jí)Ⅰ級(jí)響應(yīng),。
(1)啟動(dòng)條件。
發(fā)生特別重大疫苗藥品安全突發(fā)事件,,發(fā)生在重點(diǎn)地區(qū),、重要時(shí)段的重大疫苗藥品安全突發(fā)事件,事件本身比較敏感,、處置不當(dāng)可能造成嚴(yán)重后果的重大疫苗藥品安全突發(fā)事件,,其他需要啟動(dòng)省級(jí)Ⅰ級(jí)應(yīng)急響應(yīng)的疫苗藥品安全突發(fā)事件。
(2)啟動(dòng)程序,。
由省疫苗藥品安全突發(fā)事件應(yīng)急指揮部綜合研判提出啟動(dòng)省級(jí)Ⅰ級(jí)應(yīng)急響應(yīng)的建議,,立即向省委、省政府報(bào)告,,省委,、省政府決定啟動(dòng)省級(jí)Ⅰ級(jí)應(yīng)急響應(yīng)。第一時(shí)間向黨中央,、國(guó)務(wù)院報(bào)告,。
(3)響應(yīng)措施。
在國(guó)務(wù)院有關(guān)部門和省委,、省政府的領(lǐng)導(dǎo)下,,省疫苗藥品安全突發(fā)事件應(yīng)急指揮部組織開展事件應(yīng)急處置,各成員單位和事發(fā)地人民政府依照各自職責(zé)和國(guó)家有關(guān)部門要求開展工作,。
①會(huì)商研判,。省疫苗藥品安全突發(fā)事件應(yīng)急指揮部進(jìn)入緊急狀態(tài),召開會(huì)議,,研究部署應(yīng)急處置工作;
②信息收集,。及時(shí)收集、匯總,、核實(shí),、評(píng)估事件信息和應(yīng)急處置進(jìn)展情況,。建立日?qǐng)?bào)告制度,做好信息報(bào)告通報(bào);
③信息上報(bào),。省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室及時(shí)將有關(guān)情況報(bào)告國(guó)家藥品監(jiān)督管理局,、省人民政府,并及時(shí)續(xù)報(bào)有關(guān)情況,。必要時(shí),,請(qǐng)求國(guó)家支援;
④停產(chǎn)停業(yè)。根據(jù)事件的種類和性質(zhì),,必要時(shí)采取停產(chǎn),、停業(yè)、停辦大型活動(dòng),、隔離等措施;
⑤緊急控制,。省藥品監(jiān)管局組織核實(shí)引發(fā)突發(fā)事件的疫苗藥品品種及生產(chǎn)批號(hào),依法采取緊急控制措施,。監(jiān)督該產(chǎn)品的生產(chǎn),、經(jīng)營(yíng)企業(yè)在應(yīng)急程序啟動(dòng)后24小時(shí)內(nèi)向各自的銷售對(duì)象發(fā)出通知,暫停該品種或批次產(chǎn)品的銷售,、使用,,并于應(yīng)急程序啟動(dòng)后48小時(shí)內(nèi)逐級(jí)匯總該產(chǎn)品的全部生產(chǎn)和銷售情況;監(jiān)督企業(yè)召回相關(guān)疫苗藥品;
⑥醫(yī)療救治。省衛(wèi)生健康委采取緊急處理措施,,指定有條件的醫(yī)院集中收治受傷害患者,。組織醫(yī)療救治專家趕赴事發(fā)地,組織指導(dǎo)醫(yī)療機(jī)構(gòu)救治患者,、篩查和確認(rèn)可疑病例,,必要時(shí),報(bào)請(qǐng)國(guó)家衛(wèi)生健康委派出國(guó)家級(jí)醫(yī)療專家,,趕赴事發(fā)地指導(dǎo)醫(yī)療救治工作,。提出保護(hù)公眾身體健康的措施建議,做好患者的心理援助;
⑦隨訪登記,。事發(fā)地藥品監(jiān)督管理部門配合衛(wèi)生健康部門組織醫(yī)療機(jī)構(gòu)對(duì)已經(jīng)接種、服用或接觸引發(fā)突發(fā)事件的疫苗藥品,,但目前尚未出現(xiàn)傷害的人群,,開展隨訪、登記和求助輔導(dǎo);
⑧事件調(diào)查,。組織有關(guān)部門和機(jī)構(gòu)開展事件調(diào)查,,盡快查明事件發(fā)生原因,研究提出防范措施和處置意見,,提交調(diào)查報(bào)告,。如涉及外省企業(yè)或產(chǎn)品的,,視情與外省藥品監(jiān)督管理部門做好對(duì)接;
⑨治安維護(hù)。指導(dǎo)事發(fā)地人民政府加強(qiáng)社會(huì)治安管理,,嚴(yán)厲打擊編造傳播事件謠言,、制造社會(huì)恐慌、趁機(jī)擾亂社會(huì)秩序等違法犯罪行為,,加強(qiáng)對(duì)救助患者的醫(yī)療機(jī)構(gòu),、涉事生產(chǎn)經(jīng)營(yíng)單位、應(yīng)急物資存放點(diǎn)等重點(diǎn)地區(qū)的治安管控,,密切關(guān)注社會(huì)動(dòng)態(tài),,做好患者及親屬安撫、信訪接訪等工作,,化解各類矛盾糾紛,,防止發(fā)生群體性事件,維護(hù)社會(huì)穩(wěn)定;
⑩跟蹤監(jiān)測(cè),。做好涉事產(chǎn)品的跟蹤監(jiān)測(cè)工作,,檢索查詢相關(guān)資料,匯總相關(guān)信息;
?穩(wěn)定市場(chǎng)秩序,。各級(jí)藥品監(jiān)督管理部門組織力量加強(qiáng)對(duì)疫苗藥品市場(chǎng)巡查以及對(duì)疫苗藥品生產(chǎn)(配制),、經(jīng)營(yíng)和使用單位的檢查,規(guī)范疫苗藥品的供貨渠道,,打擊制假售假和無證經(jīng)營(yíng)等違法行為,,確保市場(chǎng)秩序穩(wěn)定;
?信息發(fā)布。及時(shí)向社會(huì)發(fā)布事件及調(diào)查處理等信息,,設(shè)立并對(duì)外公布咨詢電話,,密切關(guān)注社會(huì)及網(wǎng)絡(luò)輿情,做好輿論引導(dǎo)工作,。根據(jù)事件處置進(jìn)展和需要組織新聞發(fā)布,,客觀、準(zhǔn)確地發(fā)布事件信息,。開展相關(guān)科普知識(shí)宣傳教育,,消除公眾恐慌心理。
5.3.2??省級(jí)Ⅱ級(jí)響應(yīng),。
(1)啟動(dòng)條件,。
發(fā)生重大疫苗藥品安全突發(fā)事件,發(fā)生在重點(diǎn)地區(qū),、重要時(shí)段的較大疫苗藥品安全突發(fā)事件,,事件本身比較敏感、處置不當(dāng)可能造成嚴(yán)重后果的較大疫苗藥品安全突發(fā)事件,其他需要啟動(dòng)省級(jí)Ⅱ級(jí)應(yīng)急響應(yīng)的疫苗藥品安全突發(fā)事件,。
(2)啟動(dòng)程序,。
由省疫苗藥品安全突發(fā)事件應(yīng)急指揮部綜合研判,提出啟動(dòng)省級(jí)Ⅱ級(jí)應(yīng)急響應(yīng)的建議,,立即向省委,、省政府報(bào)告,由省人民政府啟動(dòng)省級(jí)Ⅱ級(jí)應(yīng)急響應(yīng),,第一時(shí)間向國(guó)務(wù)院報(bào)告,。
(3)響應(yīng)措施。
在省委,、省政府的指導(dǎo)下,,省疫苗藥品安全突發(fā)事件應(yīng)急指揮部組織開展事件應(yīng)急處置,各成員單位和事發(fā)地人民政府依照各自職責(zé)和有關(guān)部門要求開展工作,。
省應(yīng)急指揮部參照省級(jí)Ⅰ級(jí)響應(yīng)有關(guān)措施組織開展應(yīng)急處置,。
5.3.3??省級(jí)Ⅲ級(jí)響應(yīng)。
(1)啟動(dòng)條件,。
發(fā)生較大疫苗藥品安全突發(fā)事件,,發(fā)生在重點(diǎn)地區(qū)、重要時(shí)段的一般疫苗藥品安全突發(fā)事件,,事件本身比較敏感,、處置不當(dāng)可能造成嚴(yán)重后果的一般疫苗藥品安全突發(fā)事件,其他需要啟動(dòng)省級(jí)Ⅲ級(jí)應(yīng)急響應(yīng)的疫苗藥品安全突發(fā)事件,。
(2)啟動(dòng)程序,。
經(jīng)省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室綜合研判提出啟動(dòng)省級(jí)Ⅲ級(jí)應(yīng)急響應(yīng)建議,立即向省疫苗藥品安全突發(fā)事件應(yīng)急指揮部報(bào)告,,由省疫苗藥品安全突發(fā)事件應(yīng)急指揮部決定啟動(dòng)省級(jí)Ⅲ級(jí)應(yīng)急響應(yīng),,并第一時(shí)間向省委、省政府報(bào)告,。
(3)響應(yīng)措施,。
在省疫苗藥品安全突發(fā)事件應(yīng)急指揮部的指導(dǎo)下,由事發(fā)地市(州)人民政府組織開展事件應(yīng)急處置工作,,省疫苗藥品安全突發(fā)事件應(yīng)急指揮部采取以下措施,。
①及時(shí)調(diào)度會(huì)商,密切跟蹤事件發(fā)展;
②必要時(shí)派出工作組進(jìn)行指導(dǎo);
③根據(jù)市(州)請(qǐng)求,,給予必要的力量,、物資、裝備,、技術(shù)等支持。
5.3.4??省級(jí)Ⅳ級(jí)響應(yīng)。
(1)啟動(dòng)條件,。
發(fā)生一般疫苗藥品安全突發(fā)事件,,其他需要啟動(dòng)省級(jí)Ⅳ級(jí)響應(yīng)的疫苗藥品安全突發(fā)事件。
(2)啟動(dòng)程序,。
由省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室視情決定啟動(dòng)省級(jí)Ⅳ級(jí)應(yīng)急響應(yīng),,并第一時(shí)間向省疫苗藥品安全突發(fā)事件應(yīng)急指揮部報(bào)告。
(3)響應(yīng)措施,。
由事發(fā)地縣(市,、區(qū)、行委)人民政府組織開展事件應(yīng)急處置工作,,省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室視情給予事發(fā)地必要的技術(shù)支持,。
5.4??信息發(fā)布。
疫苗藥品安全突發(fā)事件信息發(fā)布應(yīng)堅(jiān)持實(shí)事求是,、及時(shí)準(zhǔn)確,、客觀公正的原則,由省疫苗藥品安全突發(fā)事件應(yīng)急指揮部或者授權(quán)其新聞宣傳組統(tǒng)一協(xié)調(diào),、組織報(bào)道,,通過接受記者采訪、召開新聞發(fā)布會(huì)等多種方式,,利用廣播,、電視、報(bào)紙,、人民政府網(wǎng)站,、重點(diǎn)新聞網(wǎng)站、微博,、微信等多種途徑,,發(fā)布事件及應(yīng)急處置工作情況,回應(yīng)社會(huì)關(guān)切,,澄清不實(shí)信息,,正確引導(dǎo)輿論。
省疫苗藥品安全突發(fā)事件應(yīng)急指揮部應(yīng)當(dāng)在第一時(shí)間向社會(huì)發(fā)布簡(jiǎn)要信息,,并根據(jù)事件發(fā)展情況,,組織做好后續(xù)信息發(fā)布工作。信息發(fā)布內(nèi)容應(yīng)當(dāng)包括事件概況,、嚴(yán)重程度,、影響范圍、應(yīng)對(duì)措施,、需要公眾配合采取的措施,、公眾防范常識(shí)和事件處理進(jìn)展情況等,。
5.5??響應(yīng)調(diào)整。
在事件處置過程中,,應(yīng)遵循事件發(fā)生,、發(fā)展的客觀規(guī)律,結(jié)合實(shí)際情況和處置工作需要,,根據(jù)評(píng)估結(jié)果及時(shí)調(diào)整應(yīng)急響應(yīng)級(jí)別,。
(1)級(jí)別提升。當(dāng)事件進(jìn)一步加重,,影響和危害有擴(kuò)大蔓延趨勢(shì),,情況復(fù)雜難以控制時(shí),應(yīng)當(dāng)及時(shí)提升響應(yīng)級(jí)別,。
重點(diǎn)區(qū)域或重要活動(dòng)期間發(fā)生疫苗藥品安全突發(fā)事件時(shí),,可提高響應(yīng)級(jí)別,加大應(yīng)急處置力度,,確保迅速,、有效控制事件的影響和危害。
(2)級(jí)別降低,。當(dāng)事件危害或不良影響得到有效控制,,經(jīng)研判認(rèn)為事件危害或不良影響降低到原級(jí)別評(píng)估標(biāo)準(zhǔn)以下,且無進(jìn)一步蔓延趨勢(shì)的,,應(yīng)當(dāng)及時(shí)降低應(yīng)急響應(yīng)級(jí)別,。
5.6響應(yīng)終止。
疫苗藥品安全突發(fā)事件得到有效控制后,,根據(jù)相關(guān)單位和專家研判結(jié)果,,經(jīng)省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室提出終止應(yīng)急響應(yīng)的建議,按啟動(dòng)應(yīng)急響應(yīng)權(quán)限作出終止應(yīng)急響應(yīng)的決定,。
6??后期處置
6.1??善后處置,。
疫苗藥品安全突發(fā)事件的善后處置主要包括人員安置、補(bǔ)償,,征用物資及運(yùn)輸工具補(bǔ)償;應(yīng)急處置及醫(yī)療機(jī)構(gòu)墊付費(fèi)用,、事件受害者后續(xù)治療費(fèi)用、涉事產(chǎn)品抽樣及檢驗(yàn)費(fèi)用的及時(shí)撥付;污染物收集,、清理與處理;對(duì)所涉及人員進(jìn)行心理援助;涉及外省市,、港澳臺(tái)和國(guó)外的有關(guān)善后處置工作等。
(1)事發(fā)地人民政府及有關(guān)部門應(yīng)積極做好善后處置工作,,盡快妥善安置,、慰問受影響人員,消除事件影響,,恢復(fù)正常秩序,,確保社會(huì)穩(wěn)定,。
(2)事件責(zé)任單位和責(zé)任人應(yīng)當(dāng)按照有關(guān)規(guī)定對(duì)受害人給予賠償或補(bǔ)償。
6.2??事件調(diào)查,。
疫苗藥品安全突發(fā)事件得到控制后,,應(yīng)當(dāng)按照《中華人民共和國(guó)藥品管理法》《中華人民共和國(guó)疫苗管理法》《中華人民共和國(guó)藥品管理法實(shí)施條例》《醫(yī)療器械監(jiān)督管理?xiàng)l例》《化妝品監(jiān)督管理?xiàng)l例》等法律、法規(guī),、規(guī)章和有關(guān)規(guī)定,及時(shí)組織開展事件調(diào)查處理,。
6.3??總結(jié)評(píng)估,。
疫苗藥品安全突發(fā)事件處置工作結(jié)束后,省,、市(州),、縣(市、區(qū),、行委)應(yīng)急指揮機(jī)構(gòu)辦公室應(yīng)當(dāng)及時(shí)組織相關(guān)部門開展應(yīng)急處置工作評(píng)估,,總結(jié)經(jīng)驗(yàn)教訓(xùn),分析事件原因和影響因素,,評(píng)估應(yīng)急處置工作開展情況和效果,,提出對(duì)類似事件的防范和處置建議,形成總結(jié)評(píng)估報(bào)告,。
6.4??責(zé)任與獎(jiǎng)懲,。
疫苗藥品安全突發(fā)事件應(yīng)急處置工作結(jié)束后,根據(jù)相關(guān)法律法規(guī),,對(duì)遲報(bào),、謊報(bào)、瞞報(bào)和漏報(bào)突發(fā)事件重要情況,,應(yīng)急處置不力,,或者應(yīng)急處置工作中有其他失職、瀆職行為的,,依照有關(guān)規(guī)定給予處分;構(gòu)成犯罪的,,依法追究其刑事責(zé)任。
對(duì)做出突出貢獻(xiàn)的集體和個(gè)人,,應(yīng)按照有關(guān)規(guī)定給予表彰和獎(jiǎng)勵(lì),。
7??應(yīng)急保障
7.1??隊(duì)伍保障。
強(qiáng)化應(yīng)急處置專業(yè)隊(duì)伍能力建設(shè),,各級(jí)人民政府適時(shí)組織開展應(yīng)急培訓(xùn)和演練,,提高事件快速響應(yīng)和應(yīng)急處置能力。疫苗藥品安全突發(fā)事件應(yīng)急處置專業(yè)隊(duì)伍及其他相關(guān)應(yīng)急隊(duì)伍應(yīng)當(dāng)積極參加事件應(yīng)對(duì)工作,。應(yīng)當(dāng)充分發(fā)揮應(yīng)急處置專家隊(duì)伍作用,,為事件應(yīng)急處置制定方案,、評(píng)估危害等工作提供咨詢建議。
7.2??信息保障,。
省藥品監(jiān)管局應(yīng)會(huì)同有關(guān)部門充分利用大數(shù)據(jù)技術(shù),,疫苗藥品不良事件監(jiān)測(cè)、疫苗預(yù)防接種異常反應(yīng),、藥物濫用監(jiān)測(cè),、藥品檢驗(yàn)檢測(cè)、審核查驗(yàn),、投訴舉報(bào)等疫苗藥品安全信息與熱點(diǎn)敏感信息進(jìn)行采集,、監(jiān)測(cè)和分析。各級(jí)市場(chǎng)監(jiān)督管理部門應(yīng)當(dāng)充分發(fā)揮協(xié)管員,、信息員和志愿者的作用,,暢通信息報(bào)告渠道,確保事件信息及時(shí)收集,、報(bào)送,。
7.3??醫(yī)療保障。
衛(wèi)生健康部門應(yīng)當(dāng)發(fā)揮應(yīng)急醫(yī)療救治體系的作用,,在事件造成人員傷害時(shí),,及時(shí)組織開展醫(yī)療救治工作。
7.4??技術(shù)保障,。
各級(jí)人民政府及其有關(guān)部門應(yīng)當(dāng)提高事件監(jiān)測(cè),、預(yù)警、預(yù)防和應(yīng)急檢驗(yàn)檢測(cè)等技術(shù)水平,,促進(jìn)交流與合作,,為疫苗藥品突發(fā)事件應(yīng)急處置提供技術(shù)保障。
7.5??后勤保障,。
各級(jí)人民政府及其有關(guān)部門應(yīng)當(dāng)對(duì)疫苗藥品安全突發(fā)事件應(yīng)急處置所需設(shè)施,、設(shè)備和物資的儲(chǔ)備與調(diào)用提供有效的保障,提供應(yīng)急處置資金,,所需經(jīng)費(fèi)列入同級(jí)財(cái)政預(yù)算;建立應(yīng)急裝備,、物資儲(chǔ)備體系,并做好應(yīng)急裝備,、物資儲(chǔ)備使用后的補(bǔ)充,。
7.6??社會(huì)動(dòng)員保障。
各級(jí)人民政府及其有關(guān)部門應(yīng)當(dāng)根據(jù)事件應(yīng)急處置的需要,,動(dòng)員和組織社會(huì)力量協(xié)助參與應(yīng)急處置工作;必要時(shí),,依法征用企業(yè)及個(gè)人物資。在應(yīng)急處置中動(dòng)用社會(huì)力量或企業(yè),、個(gè)人物資的,,應(yīng)當(dāng)及時(shí)歸還或給予補(bǔ)償,。
8??預(yù)案管理
8.1??預(yù)案編制與備案。
(1)本預(yù)案由省藥品監(jiān)管局編制,,各市(州),、縣(市、區(qū),、行委)應(yīng)當(dāng)參照本預(yù)案,,結(jié)合實(shí)際情況制定疫苗藥品安全突發(fā)事件應(yīng)急預(yù)案,按程序報(bào)本級(jí)人民政府批準(zhǔn),,以人民政府辦公室名義印發(fā)實(shí)施,,報(bào)上一級(jí)主管部門備案,抄送上級(jí)應(yīng)急管理部門,。
(2)疫苗藥品安全突發(fā)事件應(yīng)急預(yù)案編制過程中,應(yīng)廣泛聽取有關(guān)部門,、單位和專家的意見,,涉及其他單位職責(zé)的,應(yīng)當(dāng)書面征求相關(guān)單位意見,,必要時(shí)向社會(huì)公開征求意見,。
8.2??預(yù)案演練。
各級(jí)人民政府及其相關(guān)部門應(yīng)當(dāng)至少每?jī)赡杲M織一次應(yīng)急預(yù)案演練,,提高本地區(qū),、本部門疫苗藥品安全突發(fā)事件應(yīng)急處置能力。
8.3??預(yù)案評(píng)估與修訂,。
(1)應(yīng)急預(yù)案編制單位建立定期評(píng)估制度,,組織專家分析評(píng)估預(yù)案內(nèi)容的針對(duì)性、實(shí)用性和可操作性,,實(shí)現(xiàn)應(yīng)急預(yù)案的動(dòng)態(tài)優(yōu)化和科學(xué)規(guī)范管理,。
(2)有下列情形之一的,應(yīng)當(dāng)及時(shí)修訂應(yīng)急預(yù)案:
①有關(guān)法律,、法規(guī),、規(guī)章、標(biāo)準(zhǔn),、上位預(yù)案中的有關(guān)規(guī)定發(fā)生變化的;
②應(yīng)急指揮機(jī)構(gòu)及其職責(zé)發(fā)生重大調(diào)整的;
③面臨的風(fēng)險(xiǎn)發(fā)生重大變化的;
④重要應(yīng)急資源發(fā)生重大變化的;
⑤在疫苗藥品安全突發(fā)事件應(yīng)對(duì)和應(yīng)急演練中發(fā)現(xiàn)需做重大調(diào)整的;
⑥應(yīng)急預(yù)案制定單位認(rèn)為應(yīng)當(dāng)修訂的其他情況,。
8.4??宣傳與培訓(xùn)。
各級(jí)市場(chǎng)監(jiān)督管理,、衛(wèi)生健康等有關(guān)部門應(yīng)當(dāng)對(duì)藥品監(jiān)督管理人員,、疫苗上市許可持有人、藥品上市許可持有人,、疫苗藥品生產(chǎn)經(jīng)營(yíng)者,、醫(yī)療衛(wèi)生人員及社會(huì)公眾開展應(yīng)急知識(shí)宣傳,、教育與培訓(xùn),增強(qiáng)應(yīng)急責(zé)任意識(shí),,提高公眾的風(fēng)險(xiǎn)意識(shí)和防范能力,。
9??附則
9.1??預(yù)案解釋。
本預(yù)案由省藥品監(jiān)管局負(fù)責(zé)解釋,。
9.2??預(yù)案實(shí)施,。
本預(yù)案自發(fā)布之日起施行。
附件:1.省疫苗藥品安全突發(fā)事件應(yīng)急指揮部成員單位職責(zé)
2.預(yù)案相關(guān)名詞術(shù)語(yǔ)釋義
3.疫苗藥品安全突發(fā)事件信息報(bào)告表(初報(bào))
4.疫苗藥品安全突發(fā)事件信息報(bào)告表(續(xù)報(bào))
5.疫苗藥品安全突發(fā)事件信息報(bào)告
附件1
省疫苗藥品安全突發(fā)事件應(yīng)急指揮部
成員單位職責(zé)
省委宣傳部:組織指導(dǎo)新聞單位做好疫苗藥品安全突發(fā)事件信息發(fā)布和宣傳報(bào)道工作,,正確引導(dǎo)社會(huì)輿情,。
省委網(wǎng)信辦:負(fù)責(zé)做好互聯(lián)網(wǎng)輿情的監(jiān)測(cè)分析,加強(qiáng)疫苗藥品安全突發(fā)事件輿情管理,。
省教育廳:協(xié)助處置發(fā)生在學(xué)?;蛲杏讬C(jī)構(gòu)的疫苗藥品安全突發(fā)事件,做好在校學(xué)生,、教職工的宣傳教育和自我防護(hù)工作,。
省工業(yè)和信息化廳:配合相關(guān)部門做好應(yīng)急處置相關(guān)藥品的保障供應(yīng)工作。
省公安廳:負(fù)責(zé)組織查處,、協(xié)調(diào)指導(dǎo)疫苗藥品安全突發(fā)事件涉嫌犯罪案件的偵查工作;負(fù)責(zé)指導(dǎo)做好事件發(fā)生地現(xiàn)場(chǎng)秩序維護(hù)和社會(huì)穩(wěn)定工作,,嚴(yán)厲打擊網(wǎng)絡(luò)謠言。
省民政廳:負(fù)責(zé)指導(dǎo)社會(huì)捐助工作;對(duì)符合條件的困難群眾給予最低生活保障和臨時(shí)救助,。
省司法廳:負(fù)責(zé)疫苗藥品安全突發(fā)事件受人身?yè)p害人員法律援助等相關(guān)事宜。
省財(cái)政廳:負(fù)責(zé)疫苗藥品安全突發(fā)事件應(yīng)急處置等工作所需經(jīng)費(fèi)的保障和使用管理,。
省交通運(yùn)輸廳:負(fù)責(zé)疫苗藥品安全突發(fā)事件道路運(yùn)輸應(yīng)急運(yùn)力保障,,開通應(yīng)急通道,保障應(yīng)急人員,、車輛通行。
省衛(wèi)生健康委:負(fù)責(zé)組織實(shí)施疫苗藥品安全突發(fā)事件患者(疫苗受種者)的醫(yī)療救治及心理康復(fù);督促指導(dǎo)醫(yī)療衛(wèi)生機(jī)構(gòu)做好疫苗藥品不良事件報(bào)告工作,。根據(jù)藥品監(jiān)管部門通報(bào)情況,,對(duì)醫(yī)療機(jī)構(gòu)使用的涉事疫苗藥品采取暫停使用等緊急措施,,配合做好事件調(diào)查等工作,。
省應(yīng)急廳:負(fù)責(zé)疫苗藥品安全突發(fā)事件中涉及群眾安置和基本生活保障工作的落實(shí)。
省市場(chǎng)監(jiān)管局:負(fù)責(zé)支持、指導(dǎo)省藥品監(jiān)管局做好疫苗藥品安全突發(fā)事件調(diào)查和處置工作,。
省通信管理局:負(fù)責(zé)疫苗藥品安全突發(fā)事件應(yīng)急處置通信保障工作,。
省廣電局:配合疫苗藥品安全突發(fā)事件應(yīng)急信息發(fā)布,。
省藥品監(jiān)管局:負(fù)責(zé)省疫苗藥品安全突發(fā)事件應(yīng)急指揮部辦公室日常工作;負(fù)責(zé)疫苗藥品安全突發(fā)事件信息收集,、分析、預(yù)警,、報(bào)告等;組織協(xié)調(diào)應(yīng)急處置工作;組織開展相關(guān)檢驗(yàn)監(jiān)測(cè)及技術(shù)鑒定;負(fù)責(zé)對(duì)事件中涉及違法違規(guī)行為的查處。
各成員單位在省疫苗藥品安全突發(fā)事件應(yīng)急指揮部統(tǒng)一領(lǐng)導(dǎo)下開展疫苗藥品安全突發(fā)事件應(yīng)急處置工作,,省疫苗藥品安全突發(fā)事件應(yīng)急指揮部根據(jù)處置工作需要,,可視情增加成員單位。
附件2
預(yù)案相關(guān)名詞術(shù)語(yǔ)釋義
疫苗:是指為預(yù)防,、控制疾病的發(fā)生、流行,,用于人體免疫接種的預(yù)防性生物制品,包括免疫規(guī)劃疫苗和非免疫規(guī)劃疫苗,。
藥品:是指用于預(yù)防、治療,、診斷人的疾病,有目的地調(diào)節(jié)人的生理機(jī)能并規(guī)定有適應(yīng)癥或者功能主治,、用法和用量的物質(zhì),包括中藥,、化學(xué)藥和生物制品等。
醫(yī)療器械:是指直接或者間接用于人體的儀器、設(shè)備,、器具、體外診斷試劑及校準(zhǔn)物,、材料以及其他類似或者相關(guān)的物品,包括所需要的計(jì)算機(jī)軟件;其效用主要通過物理等方式獲得,,不是通過藥理學(xué)、免疫學(xué)或者代謝的方式獲得,,或者雖然有這些方式參與但是只起輔助作用;其目的是:疾病的診斷,、預(yù)防,、監(jiān)護(hù),、治療或者緩解;損傷的診斷,、監(jiān)護(hù)、治療,、緩解或者功能補(bǔ)償;生理結(jié)構(gòu)或者生理過程的檢驗(yàn)、替代,、調(diào)節(jié)或者支持;生命的支持或者維持;妊娠控制;通過對(duì)來自人體的樣本進(jìn)行檢查,,為醫(yī)療或者診斷目的提供信息,。
化妝品:是指以涂擦,、噴灑或者其他類似方法,,施用于皮膚、毛發(fā),、指甲、口唇等人體表面,,以清潔、保護(hù)、美化,、修飾為目的的日用化學(xué)工業(yè)產(chǎn)品。
疫苗安全事件:指發(fā)生疫苗疑似預(yù)防接種異常反應(yīng),、群體不良事件,,由藥品監(jiān)管部門會(huì)同衛(wèi)生健康等部門組織專家調(diào)查診斷確認(rèn)或者懷疑與疫苗質(zhì)量有關(guān),或者日常監(jiān)督檢查和風(fēng)險(xiǎn)監(jiān)測(cè)中發(fā)現(xiàn)的疫苗安全信息,,以及其他嚴(yán)重影響公眾健康的疫苗安全事件,。
預(yù)防接種異常反應(yīng):是指合格的疫苗在實(shí)施規(guī)范接種過程中或者實(shí)施規(guī)范接種后造成受種者機(jī)體組織器官,、功能損害,,相關(guān)各方均無過錯(cuò)的藥品不良反應(yīng),。
藥品安全突發(fā)事件:指突然發(fā)生,,對(duì)社會(huì)公眾健康造成或可能造成嚴(yán)重?fù)p害,,需要采取應(yīng)急處置措施予以應(yīng)對(duì)的藥品群體不良事件、重大藥品質(zhì)量事件,,以及其他嚴(yán)重影響公眾健康的藥品安全事件,。
藥品不良反應(yīng):是指合格藥品在正常用法用量下出現(xiàn)的與用藥目的無關(guān)的有害反應(yīng)。
醫(yī)療器械不良事件:是指獲準(zhǔn)上市的質(zhì)量合格的醫(yī)療器械在正常使用情況下發(fā)生的,,導(dǎo)致或者可能導(dǎo)致人體傷害的各種有害事件,。
化妝品不良反應(yīng):是指正常使用化妝品所引起的皮膚及其附屬器官的病變,以及人體局部或者全身性的損害,。
技術(shù)支撐機(jī)構(gòu)職責(zé):
(1)藥品檢驗(yàn)機(jī)構(gòu)。主要負(fù)責(zé)對(duì)藥品質(zhì)量進(jìn)行檢驗(yàn)分析,,上報(bào)檢驗(yàn)結(jié)果,協(xié)助調(diào)查事件發(fā)生原因,,配合完成應(yīng)急處置的相關(guān)工作。
(2)藥品不良反應(yīng)/事件監(jiān)測(cè)機(jī)構(gòu),。主要負(fù)責(zé)藥品不良反應(yīng)以及麻醉藥品,、精神藥品濫用信息收集、評(píng)價(jià),、匯總,、上報(bào)工作,,配合完成應(yīng)急處置的相關(guān)工作,。
(3)疾病預(yù)防控制機(jī)構(gòu),。主要負(fù)責(zé)對(duì)事件中涉及預(yù)防接種異常反應(yīng)事件的相關(guān)資料進(jìn)行收集,、核實(shí)、流行病學(xué)調(diào)查,、分析和評(píng)價(jià),,上報(bào)評(píng)價(jià)結(jié)果,,協(xié)助調(diào)查事件危害程度,配合完成應(yīng)急處置的相關(guān)工作,。
(4)醫(yī)療機(jī)構(gòu)。按照《藥品不良反應(yīng)報(bào)告和監(jiān)測(cè)管理辦法》,,做好藥品不良反應(yīng),、藥物濫用監(jiān)測(cè)和報(bào)告工作,,加強(qiáng)機(jī)構(gòu)內(nèi)部藥品管理,,負(fù)責(zé)事件發(fā)生后患者的救治工作,,配合完成應(yīng)急處置的相關(guān)工作,。
藥品上市許可持有人:是指取得藥品注冊(cè)證書的企業(yè)或者藥品研制機(jī)構(gòu)等。藥品上市許可持有人的法定代表人,、主要負(fù)責(zé)人對(duì)藥品質(zhì)量全面負(fù)責(zé)。
“以上,、以下”:本預(yù)案所稱“以上”包括本數(shù),,“以下”不包括本數(shù),。
附件3
疫苗藥品安全突發(fā)事件信息報(bào)告表(初報(bào))
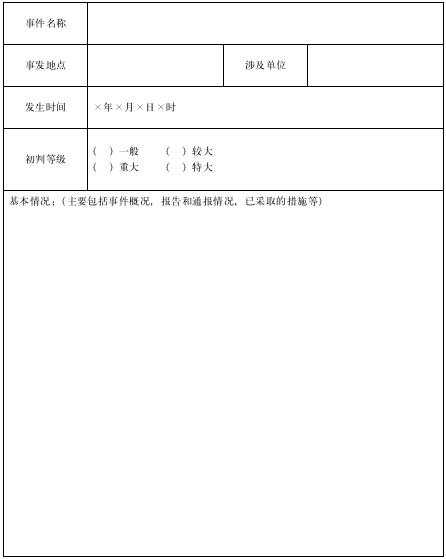
附件4
疫苗藥品安全突發(fā)事件信息報(bào)告表(續(xù)報(bào))

附件5
疫苗藥品安全突發(fā)事件信息報(bào)告


 青公網(wǎng)安備63022102000012號(hào)
青公網(wǎng)安備63022102000012號(hào)